Model là gì, cách tính khối lượng và nồng độ mol của một chất như thế nào? Hãy cùng maytaoamcongnghiep.com tìm hiểu xem mol là gì qua bài viết dưới đây nhé!

Khái niệm mol là gì lớp 8?
Định nghĩa mol là gì trong hóa học? – Mol là đơn vị đo lường được sử dụng phổ biến trong hóa học dùng cho những hạt vi mô. Nó được dùng để diễn tả lượng chất có chứa 6.02214129(27)×1023 số hạt đơn vị của phân tử hoặc nguyên tử chất nào đó.
1 mol là gì? – 1 mol là 6.02214129(27)× 1023, số 6.02214129(27)× 1023 được gọi là hằng số Avogadro và không bao giờ thay đổi. Trong các phép biến đổi đại lượng hoặc bài tập tính toán thì chúng ta có thể làm tròn N🇦 = 6,023.1023.
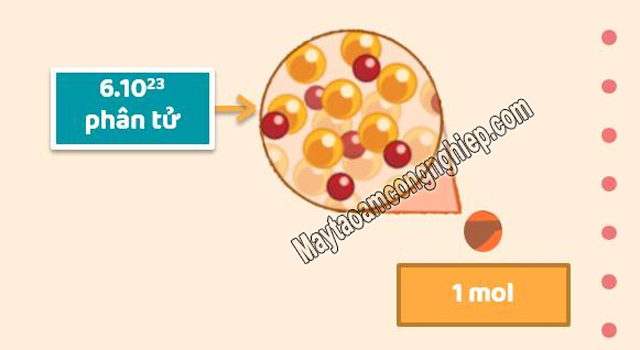
Ví dụ: 1 mol Fe là 6,023. 1023 nguyên tử Fe.
Mol được sử dụng rộng rãi trong bộ môn hóa học như cách để thể hiện lượng chất phản ứng và sản phẩm trong các phản ứng hóa học.
VD: Ta có PTHH sau:
2H2 + O2 → 2H2O
Trong phương trình trên, ta có thể hiểu là 2 mol Hidro và 1 mol Oxi phản ứng hóa học để tạo thành 2 mol nước.
Mặt khác, mol cũng được dùng để thể hiện số lượng nguyên tử, ion hay thực thể khác trong 1 mẫu nhất định của 1 chất nào đó. Nồng độ của dung dịch sẽ được biểu thị qua số mol của nó, và được định nghĩa là lượng chất hòa tan trên 1 đơn vị thể tích dung dịch đó, đơn vị thường dùng là mol/ lít.
Phần mol là gì?
Phần mol là số mol 1 thành phần của dung dịch chia cho tổng số mol của tất cả các chất trong dung dịch đó.
Ví dụ: Hãy xác định thành phần mol của NaCl trong dung dịch, trong đó có 0,10 mol muối được hòa tan trong 100g nước. Lúc này chúng ta cần xác định được khối lượng mol của nước trước.
Khối lượng riêng của H = 1, nhưng có 2 nguyên tố H => H2 = 2
Khối lượng riêng của nguyên tố O = 16
=> H20 = 2 + 16 = 18 => MH20 = 100/18 = 5,56 mol.
XNaCl = mol muối / (mol nước + mol muối) = 0,1/(5,56 + 0,1) = 0,02.

Tỉ lệ mol là gì?
Tỉ lệ mol χ (chi) là số mol của chất tan được tính theo tỉ lệ với tổng số mol trong dung dịch. VD: 1 mol chất tan hòa tan trong 9 mol dung môi thì sẽ có tỉ lệ mol là 1/10 hay là 0.1.
Nhiệt dung mol là gì?
Nhiệt dung mol đẳng áp được ký hiệu Cp là nhiệt dung tính trong quá trình biến đổi mà áp suất của hệ không đổi và được tính bằng δ.Q_p chia cho n.dT
Mol nguyên tử và mol phân tử là gì?

Phân tử và nguyên tử là những hạt có kích thước vi mô, chúng có kích thước nhỏ hơn hàng ngàn, hàng vạn lần hạt cát. Do mắt thường không thể nhìn thấy được, nên những đơn vị đo lường thông thường không thể áp dụng lên chúng được. Vì thế, các nhà khoa học đã đề xuất ra 1 đơn vị đo lường mới dành cho các hạt vi mô này là mol.
Khái niệm mol phân tử và mol nguyên tử là hoàn toàn khác nhau.
- Mol phân tử của 1 chất là lượng chất chứa N🇦 phân tử của chất đó.
- Mol nguyên tử của nguyên tố là lượng nguyên tố đó có chứa N🇦 nguyên tử của nguyên tố đó.
Ví dụ: 1 mol nguyên tử oxi sẽ chứa 6,022 x 1023 nguyên tử oxi. Còn 1 mol phân tử O2 sẽ chứa 6,022 x 1023 phân tử oxi.
Khối lượng mol là gì hóa 8?
Số mol có liên quan mật thiết đến khối lượng mol, vậy khối lượng mol được tính như thế nào?
Định nghĩa khối lượng mol
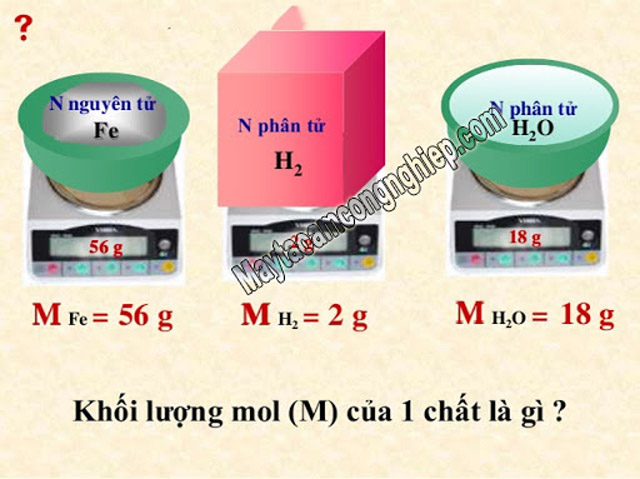
Mol là gì khối lượng mol là gì? – Khối lượng mol của 1 chất là khối lượng 1 mol phân tử hoặc phân tử chất đó, ký hiệu là M và được tính bằng gam. Khối lượng mol có trị số bằng phân tử khối hoặc nguyên tử khối chất đó, khối lượng mol của nguyên tử lấy bằng nguyên tử khối của nguyên tố trong bảng tuần hoàn nguyên tố hóa học.
Ví dụ:
Khối lượng mol của nguyên tử Ca là: M(Ca) = 40g
Khối lượng mol của nguyên tử Oxi là: M(O) = 16g
Khối lượng mol của phân tử H2O là: M(H2O) = 2×1 + 16 = 18g.
Công thức tính số mol của 1 chất là gì?
Để tính số mol của 1 chất bất kỳ, chúng ta sẽ áp dụng theo công thức sau:
n = m/M
Trong đó:
- n: Là số mol chất (tính theo đơn vị mol)
- M: Là khối lượng mol (tính theo đơn vị g/mol)
- m: Là khối lượng chất (theo đơn vị gam)
Khối lượng mol của 1 chất được hiểu là khối lượng tính bằng gam của N phân tử hoặc nguyên tử của chất đó. Khối lượng mol phân tử hay nguyên tử của 1 chất có cùng trị số với nguyên tử khối hoặc phân tử khối của chất đó.
Thể tích mol chất khí là gì? Công thức tính
Thể tích mol của chất khí là thể tích của 1 mol phân tử của chất khí đó, hiểu một cách đơn giản, thì thể tích mol của chất khí là thể tích chiếm bởi N🇦 phân tử của chất đó.
Một mol của bất kỳ của chất khí nào, đặt trong cùng điều kiện nhiệt độ áp suất đều chiếm thể tích bằng nhau. Quy ước khi t = 0 °C và P = 1 atm (khí ở điều kiện tiêu chuẩn) thì 1 mol khí bất kỳ nào cũng sẽ có thể tích là 22.4 lít.
VD: 1 mol khí O2 hoặc 1 mol khí H2 hoặc bất kỳ khí nào ở điều kiện tiêu chuẩn đều chiếm thể tích 22.4 lít.
Công thức tính mol chất khí ở ĐKTC
Để tính số mol chất khí ở điều kiện tiêu chuẩn thông qua thể tích ta có công thức sau:
n = V/22.4 (mol)
=> Ta có công thức tính thể tích chất khí ở điều kiện tiêu chuẩn khi đã biết số mol:
V = n.22,4 (lít)
Trong đó:
- n: Số mol chất khí (mol)
- V: Là thể tích chất khí khi ở điều kiện tiêu chuẩn (lít)
Công thức tính mol chất khí ở điều kiện tự nhiên
Đối với những chất khí ở điều kiện tự nhiên (không thuộc điều kiện tiêu chuẩn) thì công thức trên không còn được áp dụng để tính toán nữa. Thay vào đó, chúng ta cần phải sử dụng công thức tính số mol chất khí không trong ĐKTC:
n = PV/ RT (mol)
Trong đó:
- P: Là Áp suất(đơn vị atm)
- V: là thể tích chất khí (tính theo đơn vị lít)
- R=0.082
- T = 273 + t độ C.
Nồng độ mol là gì lớp 6?
Theo định nghĩa trong sách giáo khoa Hóa Học: Nồng độ mol (ký hiệu là CM hoặc mol) biểu thị số mol của 1 chất tan được có trong 1 lít dung dịch; và là phần trăm chất tan trong dung dịch. Công thức tính nồng độ mol:
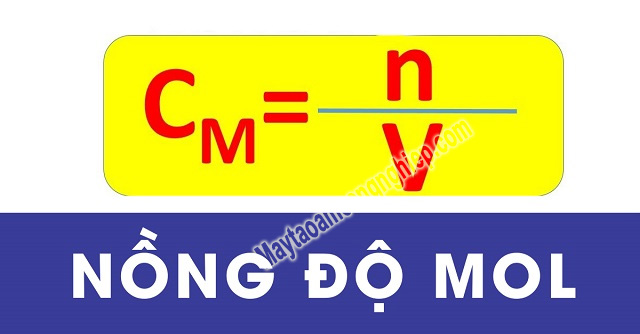
Trong đó:
- CM: Là nồng độ mol của dung dịch
- n: Số mol của chất tan;
- V: Là thể tích dung dịch (tính theo đơn vị lít).
Bài tập áp dụng tìm số mol là gì?
Để củng cố kiến thức về mol là gì công thức tính, hãy cùng làm một số bài tập ví dụ sau nhé!
Bài tập tính số mol thường gặp
Bài 1: Cho 3.9g Kali vào trong dung dịch HCl dư, hãy tính thể tích khí H2 thu được trong điều kiện tiêu chuẩn.
Lời giải:
Phản ứng sẽ xảy ra theo 2 phương trình:
2K + 2HCl → 2KCl + H2 ↑ (1)
2K + 2H2O → 2KOH + H2 ↑ (2)
Ta có số mol Kali là: nK = 3,9/39 = 0,1 mol
Theo phương trình (1) ta có: nH2 = nK = 0,1 mol
Vậy thể tích của khí H2 thu được ở điều kiện VH2 =0,1 x 22,4 = 2,24 lít.
Bài 2: Tính nồng độ mol của dung dịch khi thực hiện hòa tan 15,8g KMnO4 trong 5l nước.
Lời giải:
– Số mol của KMnO4 là: nKMnO4 = 15,8/158 =0,1mol
=> Nồng độ mol của dung dịch KMnO4 là: CM = 0,1/5 = 0,02M
Ví dụ 3: Tính khối lượng chất tan có trong 600ml dung dịch CuSO4 biết nồng độ mol là 1.5M
Lời giải:
Ta có Vdd = 500 ml = 0,5 lít
=> nCuSO4 = V x CM = 0,5 x 1,2 =0,6mol
=> Khối lượng của đồng sunfat CuSO4: nCuSO4 x MCuSO4 = 0,6 x 160 = 96gam
Trên đây là toàn bộ các thông tin chi tiết giải đáp thắc mắc Mol là gì, cách tính số mol của 1 chất bất kỳ. Hy vọng với những chia sẻ trên sẽ giúp các bạn giải quyết bài tập một cách dễ dàng.